Diferença entre Número Atômico (Z) e Número de Massa (A)
Por Fernando Buglia
 |
| www.mundoeducacao.com |
Entender
os detalhes e os cálculos que envolvem o conhecimento da estrutura
atômica moderna é fundamental para qualquer estudante, principalmente
para os vestibulandos. Afinal, essa área da química é amplamente
explorada, não só pelo Exame Nacional do Ensino Médio (Enem), como
também pelos vestibulares tradicionais que ainda restaram em vários
cantos do país.
Pensando nisso, resolvemos trazer uma boa introdução sobre alguns conceitos básicos da estrutura atômica.
Primeiramente,
é importante lembrar que, por meio dos métodos de mecânica quântica e
ondulatória, muitos conceitos dos modelos atômicos surgidos
anteriormente puderam ser corrigidos e/ou substituídos. Inclusive, já
falamos sobre os diversos modelos atômicos que apareceram ao longo do
tempo. Clique aqui e veja o artigo.
Entretanto,
de maneira bastante simplificada e didática, podemos dizer que o átomo
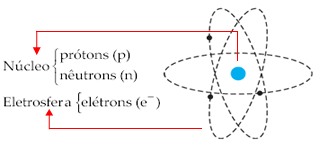
moderno é tomado com as seguintes características: Um núcleo (formado de
prótons e nêutrons) e a eletrosfera (composta pelos elétrons).
Os prótons
são partículas carregadas positivamente. Os nêutrons são partículas
neutras. Já os elétrons são partículas de massa desprezível e carga
negativa. O conjunto dos elétrons que orbitam em torno do núcleo
constitui a eletrosfera.
Portanto, de forma resumida, teremos:
- Núcleo: Prótons + Nêutrons
- Eletrosfera: Elétrons
A ilustração abaixo deixa bem clara as divisões modelo citadas:
Número atômico (Z)
Constitui
o número de prótons de um átomo. É dessa constatação que deriva um dos
conceitos mais importantes da química: o elemento químico.
Elemento químico é o conjunto de átomos que apresenta o mesmo número atômico . Ou seja, mesmo número de prótons.
Exemplos: Carbono (C), Hidrogênio(H), Oxigênio (O), Sódio (Na) etc.
Número de massa (A)
É a soma dos prótons e nêutrons do núcleo do átomo.
A= P + N
Agora
que você já entendeu a diferença entre número atômico (Z) e Número de
Massa, que tal tentar fazer um exercício bastante simples, só para fixar
o que acabou de ler? Vamos lá?
Exercício de fixação
Sabendo que o número atômico do Cálcio (Ca) é 20, e seu número de massa é igual a 40, calcule seu número de nêutrons.
Resolução: Como A= n + p, então 40 = n + 20, logo n = 20. Portanto, o número de nêutrons é igual a 20.
Continue
nos acompanhando que em breve vamos falar sobre íons (cátions e ânions)
e de como funciona a representação dos elementos químicos.
Fonte: https://www.infoenem.com.br/diferenca-entre-numero-atomico-z-e-numero-de-massa-a/
Acesso em: 18/11/2015

Nenhum comentário:
Postar um comentário